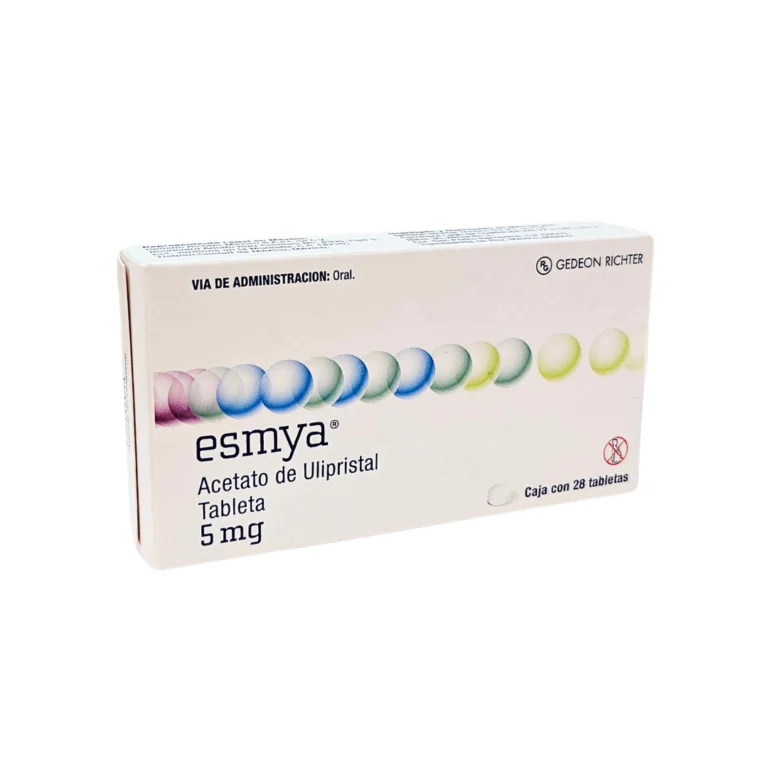
El caso del medicamento Esmya® (acetato de ulipristal 5 mg), indicado para el tratamiento de miomas uterinos, es un llamado de atención a la DIGEMID para fortalecer el proceso de registro sanitario, más allá de cumplir la formalidad de la norma vigente. Aunque este producto fue autorizado en Europa hace más de una década, su posterior retiro en 20241 pone en evidencia los riesgos de mantener el registro de un medicamento sin una permanente e independiente evaluación de su seguridad.
La trayectoria de Esmya® en Europa2
La Agencia Europea de Medicamentos (EMA) autorizó Esmya® en 2012 para el tratamiento de ciertos casos de miomas uterinos. En 2016, la autorización pasó a ser de validez ilimitada, reflejando la confianza inicial en su perfil beneficio-riesgo. En 2020, la propia EMA emitió una alerta por casos de lesión hepática grave, recomendando restringir su uso mientras se realizaba una revisión científica3. Posteriormente, el Comité de Seguridad (PRAC) concluyó que no era posible identificar a las pacientes con mayor riesgo ni establecer medidas adecuadas para prevenir los daños hepáticos.
Como consecuencia, la Comisión Europea suspendió su comercialización y, finalmente, el 18 de julio de 2024, retiró la autorización a solicitud de la farmacéutica Gedeon Richter Plc., que alegó motivos “comerciales”4. Esta medida no afecta al uso de ulipristal 30 mg unidosis, empleado como anticonceptivo de emergencia, que mantiene su autorización en Europa bajo otras marcas.
La situación en Estados Unidos
En Estados Unidos, Esmya® nunca fue aprobado para el tratamiento de fibromas uterinos. En 2017, la compañía Allergan Plc solicitó su registro ante la FDA, pero en 2018 la agencia rechazó la solicitud5, citando las mismas preocupaciones de seguridad hepática observadas en Europa.
A la fecha, el único producto con ulipristal autorizado por la FDA es ella® (30 mg), indicado únicamente para anticoncepción de emergencia.
El caso peruano: registro vigente pese al retiro europeo
En el portal de la DIGEMID, no se encuentra el registro original de Esmya®, pero sí consta su reinscripción en 20216 (RS EE0783) y su segunda reinscripción en febrero de 20247, con vigencia hasta 2030. El titular del registro es Gedeon Richter Perú S.A.C., la misma farmacéutica que decidió retirar el producto del mercado europeo.
Según el Observatorio Peruano de Productos Farmacéuticos, Esmya® está disponible en más de 2,400 establecimientos farmacéuticos, lo que evidencia su amplia circulación pese a los antecedentes de inseguridad registrados por la EMA.
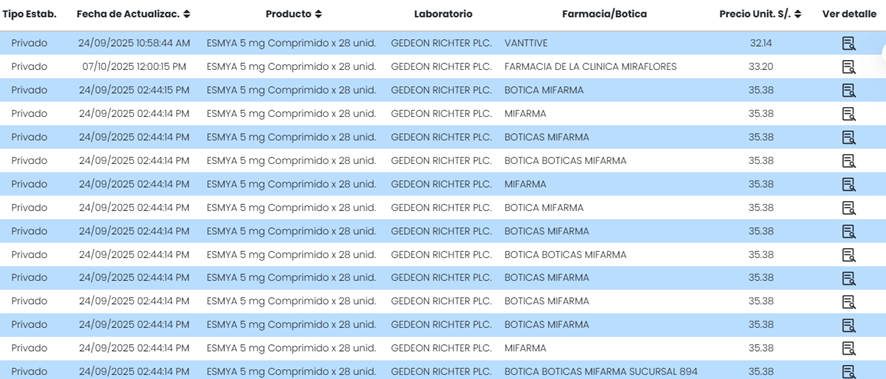
Revisado el OPPF el 21/10/2025
Reflexiones y desafíos regulatorios
a) La falsa seguridad del aval internacional “países de alta vigilancia sanitaria”
El hecho de que un medicamento sea aprobado en un país de alta vigilancia no garantiza automáticamente su seguridad ni eficacia sostenida. Esmya® fue autorizado por la EMA tras un proceso de evaluación que dura, en promedio, 210 días solo para la revisión científica, pero años después debió ser retirado. Lo que reafirma que la ciencia es dinámica y los conocimientos se van enriqueciendo y modificando.
Esto subraya la importancia de que las autoridades nacionales desarrollen una revisión propia y rigurosa, sin quedarse únicamente en la formalidad de un registro.
Recientemente se modificó la Ley 32319 que introduce la figura del “silencio administrativo positivo” para otorgar registro sanitario, en caso la autoridad no se pronuncie en un plazo de 45 días. Así, se pone limite a la evaluación de la evidencia científica disponible. A juicio de expertos y solicitada por el Colegio Médico del Perú, dicha ley debe ser derogada8.
b) Fortalecer la autonomía de DIGEMID
La limitada autonomía y escasez de recursos técnicos y humanos de la autoridad reguladora peruana dificultan evaluaciones exhaustivas. Este caso muestra la necesidad urgente de transformar DIGEMID en una entidad con independencia técnica y recursos suficientes, alineada con estándares internacionales para garantizar decisiones seguras.
c) Farmacovigilancia débil
No existen registros públicos que permitan conocer reportes de eventos adversos asociados al uso de Esmya® en Perú. De existir, no parecen haber sido analizados ni comunicados con la transparencia necesaria para orientar medidas que protejan a los pacientes y, si corresponde, determinar su retiro del mercado. Un sistema nacional de farmacovigilancia sólido y transparente es esencial para identificar los riesgos cuando un medicamento o cualquier otra tecnología sanitaria entra al mercado.
d) Más medicamentos en observación
La revista médica francesa Prescrire publica anualmente una lista de medicamentos de riesgo o sin valor terapéutico añadido que continúan en el mercado europeo. El caso de Esmya® se suma a otros ejemplos que recuerdan la importancia de una evaluación continua y no solo inicial de los productos farmacéuticos.
El caso Esmya® evidencia que una autoridad reguladora cuyas autorizaciones son un simple reflejo de las decisiones en otros países no basta. El Perú necesita una autoridad reguladora autónoma, competente y con capacidad de respuesta, así como un sistema de farmacovigilancia activo y transparente. Solo así se evitará que medicamentos retirados en otras jurisdicciones sigan circulando en nuestro país, exponiendo a las personas a riesgos que se pueden evitar.
- Anulación de la autorización https://www.ema.europa.eu/es/documents/product-information/esmya-epar-product-information_es.pdf ↩︎
- Overview Visión general https://www.ema.europa.eu/en/medicines/human/EPAR/esmya ↩︎
- Article 31 of Directive 2001/83/EC. https://www.ema.europa.eu/en/human-regulatory-overview/post-authorisation/referral-procedures-human-medicines ↩︎
- 2024 EMA/347164/2024 EMEA/H/C/002041 https://www.ema.europa.eu/en/documents/public-statement/public-statement-esmya-withdrawal-marketing-authorisation-european-union_en.pdf ↩︎
- Allergan Receives Complete Response Letter from the U.S. Food and Drug Administration for Ulipristal Acetate New Drug Application
https://news.abbvie.com/2018-08-21-Allergan-Receives-Complete-Response-Letter-from-the-U-S-Food-and-Drug-Administration-for-Ulipristal-Acetate-New-Drug-Application ↩︎ - RD N°2979 2021/DIGEMID/DPF/EMNDYO/MINSA. https://www.digemid.minsa.gob.pe/Archivos/Resoluciones/DPF/2021/RD_DPF_0002979_2021.pdf ↩︎
- RD N°17955 2024/DIGEMID/DPF/EMNDYO/MINSA. https://www.digemid.minsa.gob.pe/Archivos/Resoluciones/DPF/2024/RD_DPF_0017955_2024.pdf ↩︎
- Carta N° 4451-SIPMYSP-CMP-2025 ↩︎