En octubre de 2025, Acción Internacional para la Salud (AIS) advirtió que el medicamento Esmya® (ulipristal), indicado para el tratamiento de miomas uterinos, había sido suspendido en 2020 por la Agencia Europea del Medicamento (EMA) debido a reportes de daños hepáticos graves. Posteriormente en 2024 a solicitud de la propia farmacéutica Gedeon Richter Plc, el producto fue retirado del mercado europeo, bajo el argumento de motivos comerciales. La FDA no aprobó este medicamento, precisamente por problemas de seguridad identificados durante su evaluación.
En Perú, a pesar de estos antecedentes, el medicamento fue reinscrito por segunda vez en 2024, con Registro Sanitario N.° EE0783, vigente hasta 2030, cuyo titular es Gedeon Richter Perú S.A.C. El medicamento sigue en el mercado. Ante esta situación, el 4 de noviembre 2025, AIS dirigió una carta al Ministro de Salud, solicitando información sobre las acciones adoptadas por la DIGEMID para garantizar la seguridad de las pacientes que podrían estar expuestas a este medicamento. Hasta la fecha, no se ha recibido respuesta. El silencio institucional, en este contexto, no es un detalle menor: la falta de acciones efectivas y oportunas en estos casos mantiene en riesgo a las mujeres expuestas. Salvo que DIGEMID tenga nueva y calificada evidencia sobre la seguridad del medicamento que justifique su permanencia en el mercado.
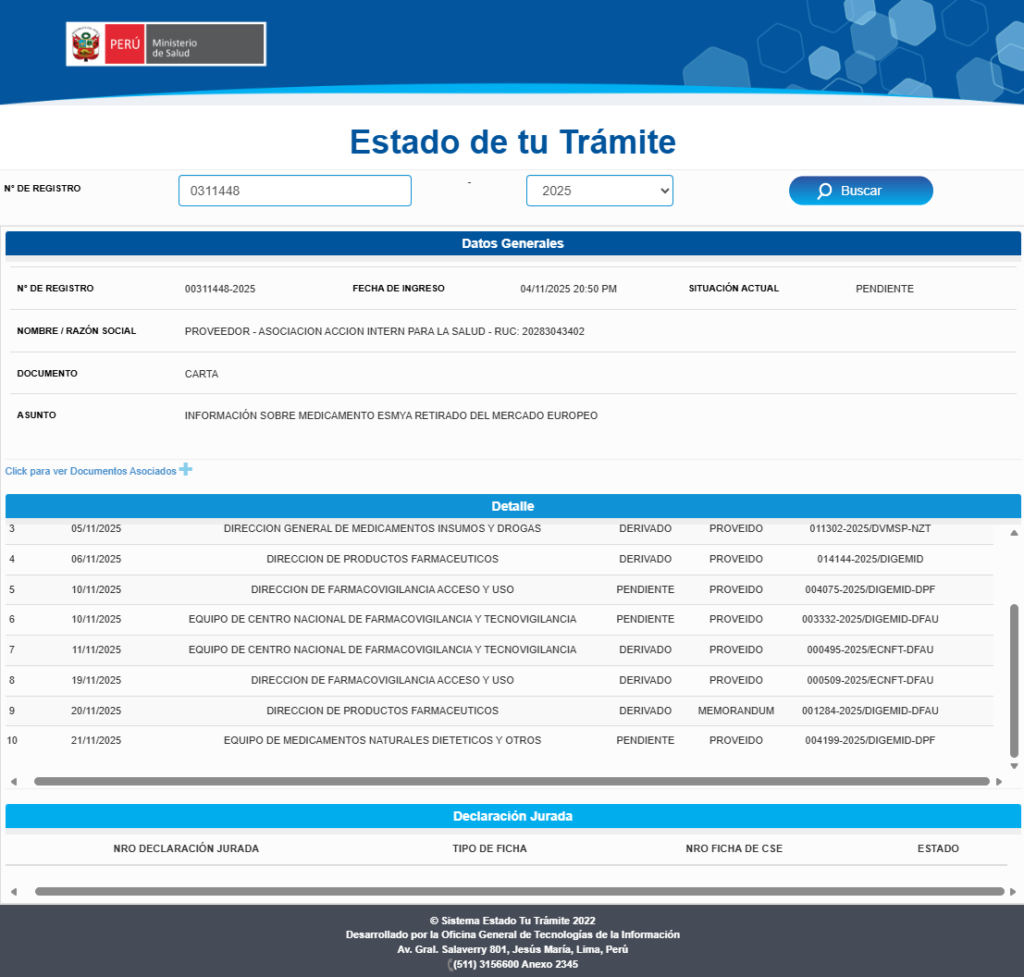
Esta situación resulta particularmente preocupante porque pone en cuestionamiento la actuación de DIGEMID. Las lesiones hepáticas como resultado del uso de ulipristal han sido completamente documentadas por la autoridad europea, y abre muchas interrogantes legítimas acerca de la actuación del organismo regulador.
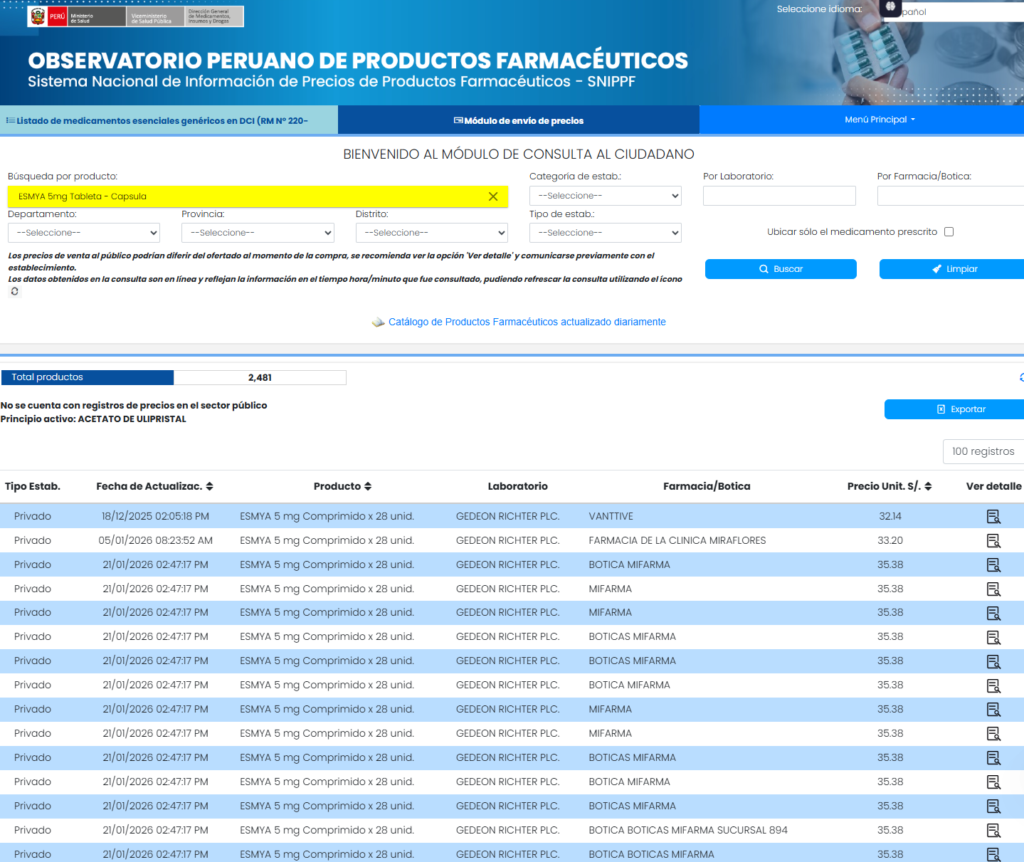
De acuerdo con el Observatorio de Precios de Medicamentos (consultado el 21 de enero), Esmya® se encuentra disponible en numerosas boticas privadas del país, lo que amplía el universo de potenciales usuarias expuestas a riesgo. Más aún porque pareciera que el programa de farmacovigilancia de la DIGEMID no opera de forma idónea.
En salud pública, la prudencia regulatoria no es alarmismo: es responsabilidad. La inacción o la demora en informar y decidir, frente a alertas internacionales de seguridad, puede traducirse en daños que podrían evitarse. Y cuando se trata de medicamentos, el silencio también enferma.